Sodavands brus
I disse sensommerdage er det lækkert at nyde en kold sodavand i solen. Men hvordan forhindrer man, at sodavanden mister sin brus?
Vi har set nærmere på tryk og temperatur, så man undgår at sidde med en flad cola og en endnu fladere fornemmelse i kroppen.
Vi kan konkludere, at det er bedst at holde sodavanden kold og lade den være lukket så længe som muligt. 1dL sodavand i lukket beholder kan nemlig indeholde 0,32 L mere CO\(_2\) end samme mængde sodavand i åben beholder. Samtidig kan 1 dL åben køleskabskold sodavand holde 0,084 L mere CO\(_2\) end samme mængde strandvarm sodavand.
Når sodavanden er åbnet, er det bedst at lade den blive i flasken i stedet for at hælde den på glas.
Sådan har vi regnet det ud
Brusen i sodavand kommer fra CO\(_2\), der er opløst i vandet. Mellem sodavandets overflade og sodavandens låg er der CO\(_2\) på gasform.
Der er ligevægt mellem CO\(_2\)'en på gasform og den CO\(_2\), der er opløst væsken: CO\(_2\)(g) \(\rightleftharpoons\) CO\(_2\)(aq). Denne ligevægt kan påvirkes af faktorer som tryk og temperatur. Lad os først se lidt nærmere på den nævnte ligevægt.
Ligevægtssystemet for kuldioxid opløst i vand
Når CO\(_2\) opløses i vand, reagerer en del af det med vandet og danner kulsyre:
\(H_2O + CO_2 \rightleftharpoons H_2CO_3\)
Den kulsyre, der dannes, giver sodavandet en frisk smag.
En del af kulsyren reagerer videre ved først at afgive først én og derefter eventuelt en anden proton til vandet:
\(H_2CO_3 + H_2O\rightleftharpoons H_3O^+ + HCO_3^-\) og \(H_2O+HCO_3^- \rightleftharpoons H_3O^+ + CO_3^{2-}\)
Vi har altså et stort system af ligevægte, og de er alle sammen afhængig af trykket af den gasformige CO\(_2\), der indgår i den første ligevægt. Ændrer man CO\(_2\)-trykket, vil alle ligevægtene blive forskudt. Samtidig kan denne ligevægt - lige som alle andre ligevægte - påvirkes af temperatur.
Tryk
I sodavanden er der et stort tryk. Det er på cirka 380 kPa, og når man åbner den, udlignes trykket, så det bliver lig det atmosfæriske tryk, 101,3 kPa. Det medfører, at CO\(_2\)'en der før var i toppen af flasken slipper ud, så trykket af CO\(_2\) falder. Det betyder, at ligevægten mellem den opløste og gasformige CO\(_2\) forskydes, så en del af den før opløste CO\(_2\) vil gå på gasform - det er det, vi ser som bobler i sodavanden.
Vi udregner, hvor meget CO\(_2\), der kan opløses i vand ved sodavandsdåsens tryk og ved atmosfærisk tryk:
Vi har set på data ved 400 kPa og ved 101,3 kPa (atmosfærens tryk) - i begge tilfælde ved 20\(^{\circ}\), så vi kan sammenligne data
Atmosfærisk tryk
Ved 101,3 kPa kan der opløses 0,1688 g/100 mL vand. Vi omregner denne mængde til den volumen, som CO\(_2\)'en ville have ved normalt tryk og temperatur vha. idealgasligningen: \(pV=nRT\), hvor p er trykket (1 atm), V er volumen, som vi er interesseret i at finde, n er stofmængden, som vi finder ved at dividere massen af \(CO_2\) med molarmassen M:
\(M_{CO_2}=M_{C}+2\cdot M_{O_2}=12,01g/mol+2\cdot16,00g/mol=44,01g/mol\)
R er gaskonstanten 0,082 \(\frac{L\cdot atm}{mol\cdot K}\). T er temperaturen i Kelvin - vi regner med 25\(^{\circ}\), som svarer til 298,15K.
Vi udregner volumen af CO\(_2\): V=\(\frac{nRT}{p}\)
\(V(CO_2)=\frac{\frac{0,1688g}{44,01g/mol}\cdot0,082\frac{L\cdot atm}{mol\cdot K}\cdot298,15K}{1atm}=0,094L\)
Der kan altså opløses, hvad der svarer til 0,094L CO\(_2\) i 0,1 L vand ved atmosfærisk tryk.
Sodavandsdåsens tryk
Vi har kun været i stand til at finde data for opløseligheden af CO\(_2\) ved 400 kPa ved 20\(^{\circ}\), og det er i enheden molprocent, nemlig 0,3 mol%. 0,3 mol% betyder, at 0,3 % af alle de mol, der er i blandingen, er vandmolekyler. Formlen for at finde molprocenten for CO\(_2\) er:
Mol%(CO\(_2\))=\(\frac{n(CO_2)}{n(CO_2)+n(H_2O)}\cdot 100\%\)
Normalt er der 55,5 mol vand i 1 L vand. Vi antager, at det er tilfældet her, da der er meget mere vand end CO\(_2\).
Vi indsætter de kendte værdier og løser ligningen vha. vores CAS-værktøj:
0,3%=\(\frac{n(CO_2)}{n(CO_2)+55,5\,mol}\cdot 100\%\)
n(CO\(_2\))=0,167 mol
Der er altså opløst, hvad der svarer til 0,167 mol pr. L vand - og 0,0167 mol pr. 100mL. Vi bruger igen idealgasligningen til at finde ud af, hvor stort et rumfang, denne CO\(_2\) har ved normalt tryk og temperatur:
V(CO\(_2\))=\(\frac{0,0167 mol\cdot0,082\frac{L\cdot atm}{mol\cdot K}\cdot298,15K}{1atm}=0,41L\)
Der kan altså opløses hvad der svarer til 0,41 L CO\(_2\), pr. 100 mL sodavand ved højt tryk.
Forskellen mellem de to resultater, \(0,41L-0,094L =0,32L\) er altså mængden af CO\(_2\), der bobler op pr. 100 mL, når man åbner sodavanden og lader den stå, indtil ligevægten på ny har indstillet sig. Det skyldes, at overtrykket forsvinder, og derved falder partialtrykket for CO\(_2\), og man kan derfor ikke opløse lige så meget CO\(_2\) i væsken.
Temperatur
Der er forskel på, hvor meget gas, der kan opløses i vand, alt efter hvad temperaturen er. Derfor vil fx verdenshavene frigive mere CO\(_2\), når det bliver varmere. Det samme gør sig gældende, når man tager en cola med på stranden.
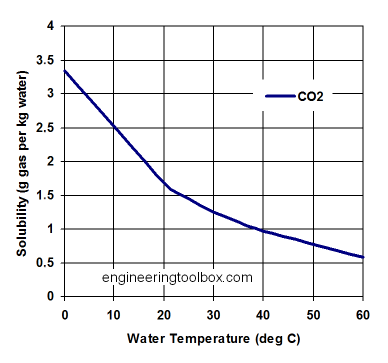
Vi udregner, hvor meget CO\(_2\), man kan opløse i vand ved køleskabstemperatur og ved strandtemperatur, når trykket svarer til normalt atmosfærisk tryk - det svarer altså til, at sodavanden er åbnet.
Ved 5\(^{\circ}\) kan der opløses 0,2774 g kuldioxid pr. 100 mL vand.
Ved 30\(^{\circ}\) kan der opløses 0,1257 g kuldioxid pr. 100 mL vand.
Vi bruger igen idealgasningen til at udregne, hvor meget \(CO_2\) (volumen ved stuetemperatur), der går på gasform, når man flytter 1 dL åben sodavand fra køleskabet til stranden:
Forskellen i masse udregnes: \(0,2774g-0,1257g=0,1517g\)
V(CO\(_2\))=\(\frac{\frac{0,1517g}{44,01g/mol}\cdot0,082\frac{L\cdot atm}{mol\cdot K}\cdot298,15K}{1atm}=0,084L\)
1 dL kold sodavand kan altså holde 0,084 L mere end 1 dL varm sodavand. Derfor er det en god idé at pakke sodavanden i en køletaske - og kold sodavand er jo også lækrest.
Glas eller flaske
Uanset om du har sodavanden til at stå i en åben flaske eller i et glas, vil trykket være det samme over væsken, så derfor vil ligevægten med atmosfærens kuldioxid begynde at indstille sig. Alligevel er der forskel på de to.
Det skyldes, at ligevægten indstiller sig i kontaktfladen mellem sodavanden og atmosfærens luft. Denne kontakt vil ofte være større i et glas end i en klassisk colaflaske, hvor flaskehalsen også vil forhindre molekylerne i at diffundere frit. Derfor vil ligevægten først indstille sig i glasset, mens sodavanden bedre holder på brusen i den smalle glasflaske.
Kilder:
http://hypertextbook.com/facts/2000/SeemaMeraj.shtml
http://www.nbi.ku.dk/spoerg_om_fysik/fysik/carbondioxid/
http://www.nbi.ku.dk/spoerg_om_fysik/fysik/sodavand/
https://en.wikipedia.org/wiki/Carbon_dioxide_(data_page)#Solubility_in_water_at
_various_temperatures
https://www.nist.gov/sites/default/files/documents/srd/jpcrd427.pdf
https://da.wikipedia.org/wiki/Gaskonstant
http://www.ausetute.com.au/molpcent.html
